Question évaluée : le témozolomide (TMZ) est un anticancéreux utilisé dans le traitement de tumeurs cérébrales chez l'adulte et l'enfant. Il n'existe pas de forme pharmaceutique adaptée aux patients ne pouvant pas avaler les gélules (notamment en pédiatrie). Une équipe de pharmaciens canadiens s'est proposé de réaliser une étude de stabilité de plusieurs formulations de témozolomide sous forme de suspension buvable.
Type d'étude : étude de stabilité
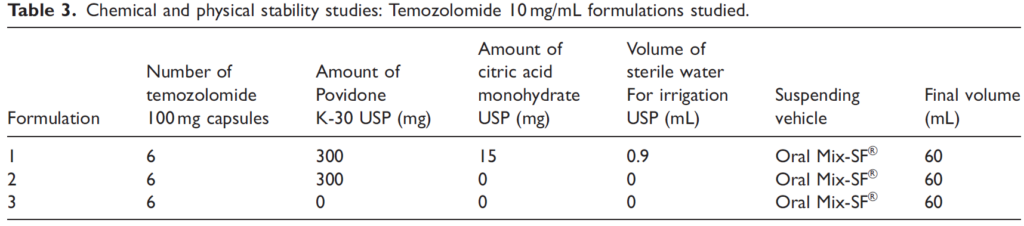
Méthode : une première série de préparations a été réalisée à différentes concentrations (Tableau 2) mais seules 3 formulations, à la concentration de 10 mg/mL, ont été sélectionné sur la base d'une étude de stabilité physique.
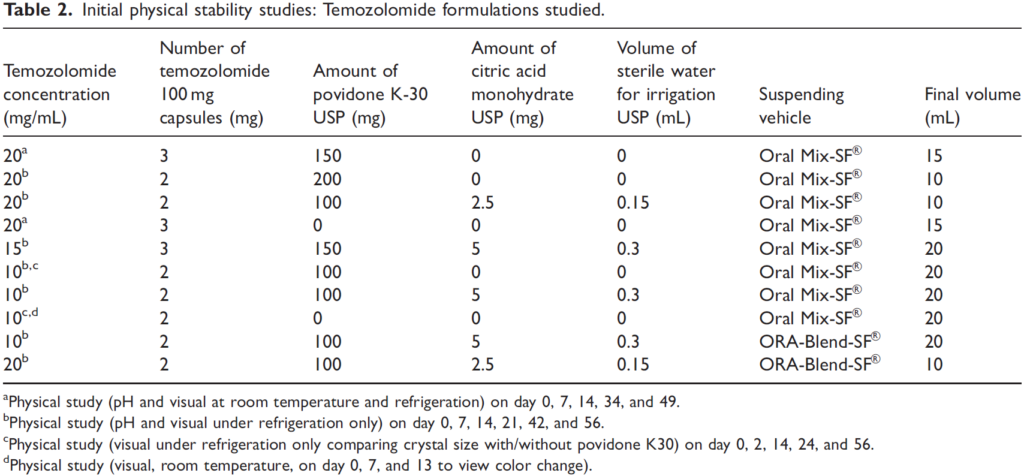
Les trois préparations sélectionnées (Tableau 3) ont été conditionnées dans un flacon en verre, en plastique (PET), en seringue pour administration orale (polypropylène). Elles étaient conservées à 4°C ou à température ambiante, à l’abri de la lumière. L'évaluation de la stabilité physique était basée sur l'aspect visuel et la mesure du pH. L'évaluation de la stabilité chimique était basée sur une méthode séparative par CLHP (longueur d'onde de détection 330 nm). La validation de la méthode impliquait :
- Dégradation forcée réalisée
- Répétabilité, reproductibilité
- Spécificité : chromatogramme TMZ+Oral mix SF® et chromatogramme Oral mix SF® seul
- Linéarité : gamme étalon 5 points
- Critère de stabilité chimique : conservation de 90% de la concentration initiale
Résultats :
1/ Étude préliminaire : les concentrations testées de 20 et 15 mg/mL présentaient des changements de coloration pour les différentes conditions testées et sont donc non-recommandées. La concentration de 10 mg/mL, conservée à 20-25°C, présente une coloration orange foncé après 7 jours et est non-recommandée également. Conservée à 4°C, la solution de 10 mg/mL présente un léger changement de coloration après 56 jours. Formation de cristaux dans toutes les suspensions.
2/ Étude de stabilité physico-chimique des 3 suspensions buvables de TMZ à 10 mg/mL :
- Validation de la méthode analytique :
- Linéarité, spécificité, reproductibilité, répétabilité : OK
- Capacité indicatrice de stabilité (avec dégradation forcée) : voir ci-après
- Pas de nécessité de rajouter de l'acide citrique ou de la povidone K-30 (PK-30) car pH<5 et formation de cristaux malgré la présence de PK-30
Points forts : Publication bien rédigée, description de la méthode analytique, validation de la méthode réalisée. L'étude de stabilité chimique retrouve une concentration en TMZ > 90% de la concentration initiale
Points faibles :
- sur la validation de la méthode analytique par dégradation forcée :
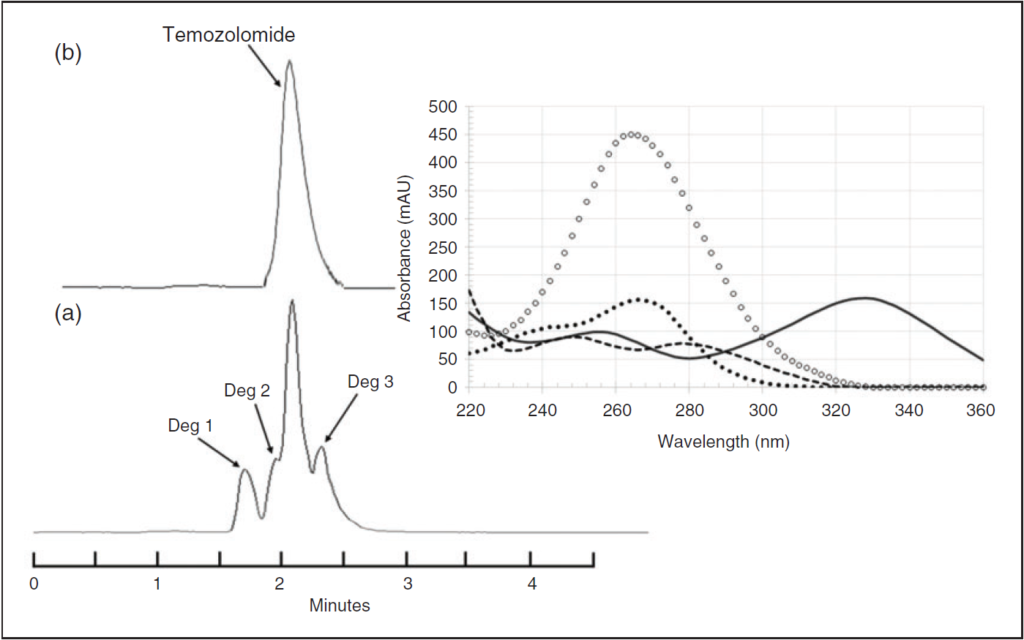
- les produits de dégradation (PD) ne sont pas détectés à 330 nm, mais ce n’est pas logique de se mettre à 330 nm car cela veut dire qu’on ne détectera pas les PD lors de l’étude de stabilité,
- les auteurs utilisent un détecteur DAD donc ils auraient pu se mettre à 330 nm pour quantifier le TMZ et à 326 nm pour détecter les PD,
- de plus les pics de PD ne sont pas bien séparés par rapport au pic de TMZ (Figure ci-dessous). Dans l’idéal, il aurait fallu modifier la phase mobile (modification du pH, proportion, concentration),
- les auteurs n’ont pas assez exploité le fait de pouvoir quantifier les PD à 326 nm ( par exemple, ça aurait été intéressant de quantifier les PD lors des changements de couleurs des suspensions).
- Sur la présence des cristaux dans les suspensions :
- les auteurs confirment que les cristaux présents dans la suspension sont du TMZ,
- ils justifient le changement de couleur par une hydrolyse du TMZ en un produit de dégradation (5-(3-monomethyl-1-triazeno)imidazole-4-carboxamide ou MTIC),
- après remise en suspension, le mélange est homogène.
Conclusion / implications en pratique : cette publication est acceptable et les données de stabilité à 4-8°C peuvent être utilisées en pratique car après agitation, la suspension est bien homogène et les suspensions à 10 mg/mL conservent >90% de la concentration initiale. Il n'est pas utile de conserver les données à température ambiante car le changement de couleur est trop important. L’ajout d’acide citrique et de povidone K-30 ne semble pas utile.
D'après Élise D'HUART


